新闻资讯
浅谈新冠病毒及多功能酶标(MMR)在其药物发现中的应用实例
- 发布时间:2021-01-04
- 访问量:
【概要描述】冠状病毒(CoronaVirus , CoV)因其表面有棘突(Spike蛋白)和整体形态似日冕状而得名。此前,可能许多人对“冠状病毒”一词并不熟悉,但其实大多数人都遇到过冠状病毒的一般温和形式,约五分之一的普通感冒也是由其下属四种毒株引起的。
浅谈新冠病毒及多功能酶标(MMR)在其药物发现中的应用实例
【概要描述】冠状病毒(CoronaVirus , CoV)因其表面有棘突(Spike蛋白)和整体形态似日冕状而得名。此前,可能许多人对“冠状病毒”一词并不熟悉,但其实大多数人都遇到过冠状病毒的一般温和形式,约五分之一的普通感冒也是由其下属四种毒株引起的。
- 发布时间:2021-01-04
- 访问量:
冠状病毒(CoronaVirus , CoV)因其表面有棘突(Spike蛋白)和整体形态似日冕状而得名。此前,可能许多人对“冠状病毒”一词并不熟悉,但其实大多数人都遇到过冠状病毒的一般温和形式,约五分之一的普通感冒也是由其下属四种毒株引起的。
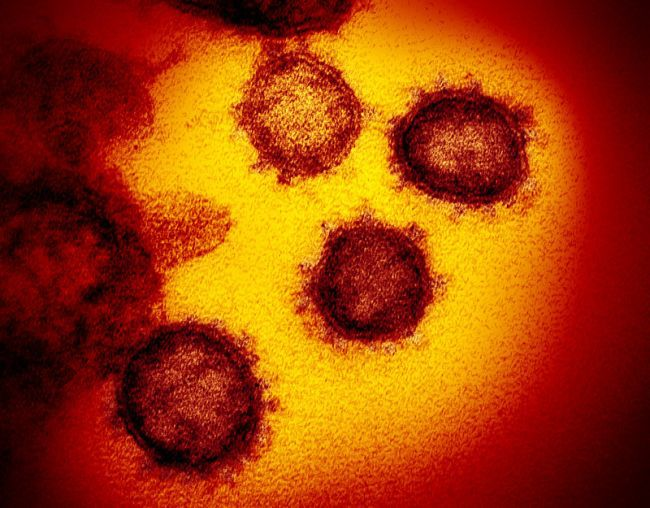 (图片来源:NIAID-RML)透射电子显微镜像-从人细胞表面出现的新冠病毒。
(图片来源:NIAID-RML)透射电子显微镜像-从人细胞表面出现的新冠病毒。
据系统发生分类,冠状病毒(CoV)是巢病毒目(Nidovirales)中的最大病毒组。冠状病毒科包括冠状病毒亚科和环曲病毒亚科,冠状病毒亚科又可分为冠状病α、β、γ和δ四个属。2019新冠病毒是目前已知的第7种可以感染人的冠状病毒,它和SARS-CoV ,MERS-CoV以及HCoV-OC43 和HCoV-HKU1均属于β型。其余2种(HCoV-229E、HCoV-NL63)则属于α型。[1][2] 新冠病毒的病毒源头目前文献报道为中华菊头蝠,但中间宿主查明可能还需要一段时间。
冠状病毒感染机制
01 Cov基因组
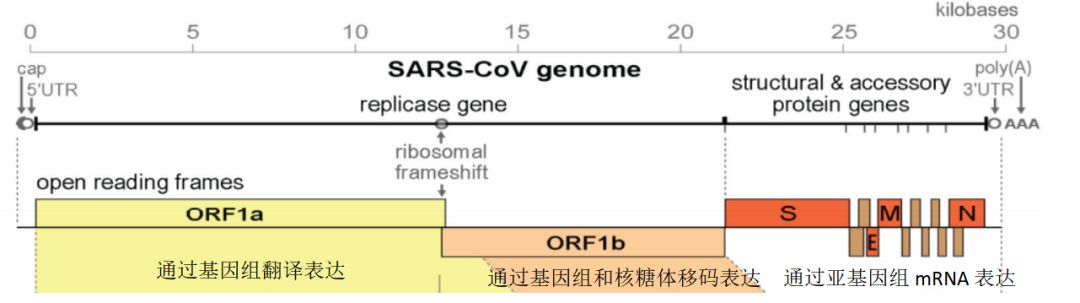
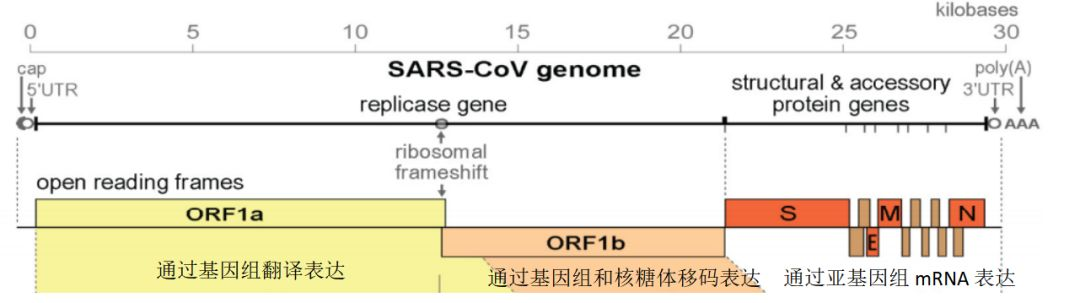
冠状病毒全基因组约30 kb(如图,新冠病毒为 29.903 Kb),均为无分段的正义单链RNA,拥有一套包含使用多种非结构蛋白(nsps)的独特复制策略。
该基因组包含5'帽以及3' poly(A)尾,可直接作为mRNA翻译复制酶多聚蛋白。编码非结构蛋白的复制酶基因占基因组的三分之二,约20 kb(2个ORFS,采用移框阅读翻译)。结构蛋白(包括S蛋白,M-膜蛋白,E-包衣, N-核衣壳,HE(β属))和辅助蛋白(Accessory)仅占病毒基因组的约10 kb。对于辅助蛋白,组织培养中显示其对复制几乎是不需要的,但已有实验表明它在病毒发病机理中有重要作用(调节干扰素信号传导,促炎性细胞因子的产生和逃避宿主先天免疫等)。
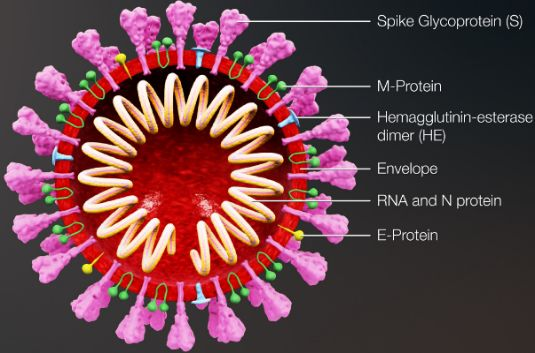
02感染过程
新冠病毒的S棘突蛋白首先识别人细胞表面受体ACE2(血管紧张素转换酶,同SARS)[2],通过吸附并内化,释放病毒基组。病毒再利用人核糖体直接翻译其正义单链RNA模板,并由核糖体移框翻译主要是多聚蛋白的产物,多聚蛋白随后由其内部的蛋白酶(如3CLpro,Mpro-PLpro等)催化剪切得到单个组成蛋白,包括重要的RNA复制酶(RdRp)等。随后,RdRp复制正义链,产生负义链,再以负链为模板,生成大量的正链,完成了RNA的复制。新的病毒RNA再结合水解酶产生的各种蛋白质,组装成了大量的新病毒,最后释放出原宿主细胞,继续狩猎新目标。
RNA复制酶错误率一般较高,但冠状病毒RNA聚合酶据报道具有一定遗传纠错的能力,更有意思的是,它忽略了对编码棘突蛋白(S蛋白)和其它辅助蛋白的编码区域纠错,因此这两个区域突变最高,成为了推动病毒的变异演化关键点,导致病毒倾向感染新细胞和新的物种,并逃避宿主免疫反应。
03临床特征
新冠病毒会引起致命性肺炎,表现非常类似于SARS。感染者可能会发展为急性呼吸窘迫综合征,接受重症监护的可能性很高,甚至死亡。细胞因子风暴可能与疾病严重程度有关。主要感染下呼吸道,对其它器官的影响和病理生理需要更多的努力来了解。
04潜在药物靶点
2003年之前,冠状病毒疾病影响很小,因而对它们的相关研究几乎停滞。但2003年的非典病毒(SARS-CoV)和2012年的中东呼吸系统综合症冠状病毒(MERS-CoV)的爆发刺激了全球对于冠状病毒的关注和研究,并确定了大量合适的抗病毒靶标,如前述病毒蛋白酶,RNA聚合酶和结合蛋白(S蛋白)。最近大家耳熟能详的瑞德西韦(核苷类似物)和克力芝就分别是RdRp(RNA依赖的RNA聚合酶)和蛋白酶的抑制剂。此外,棘突蛋白(S)不仅负责与宿主受体结合,而且还是能够诱导保护性免疫力的主要抗原决定簇。最新预印文章也表明新冠病毒结合ACE2受体的亲和力比SARS-CoV S高10-20倍,这也提示新冠病毒传染性可能远高于SARS。注:MERS-CoV受体是DPP4(二肽基肽酶4)。
MMR在疫苗和药物早期研发中应用
根据以上机理,抗新冠病毒的药物或疫苗可以归纳为两大类:一是阻止病毒和宿主细胞结合,作用靶位是S蛋白或者ACE2(MERS是DPP4)二是阻止新病毒在宿主细胞内的产生,常见作用靶位是RdRp或者病毒蛋白水解酶。
01针对S蛋白或者S蛋白与宿主细胞的结合,这里挑选一篇涉及方法学的文章,希望此文能给新冠病毒疫苗和药物研发及未来的优化工作提供安全和高效的方法学参考[5]。
文中采用了表达S蛋白的伪病毒去代替天然CoV的方法去检测和筛选MERS疫苗或小分子药物,免除科研人员必须在P3或以上级别实验室的诸多不便,并且显示出和野生病毒基本一致的实验效果。(伪病毒一般为人工改造可表达目的病毒蛋白的γ逆转录病毒和慢病毒载,据多处文献报道在流感病毒研究中显现了极高的应用价值[7]。
主要的实验流程包括:准备实验需要的细胞株并构建可表达MERS-CoV S蛋白的质粒(含荧光素酶HIV-1骨架),然后生产表达S蛋白的伪病毒(pseudovirus),并使用Tecan MMR化学发光检测伪病毒对各类型细胞的感染力,最后进行细胞学中和或抑制实验,并再用化学发光检测药物或疫苗在细胞学水平对MERS-CoV伪病毒中和或抑制效应。
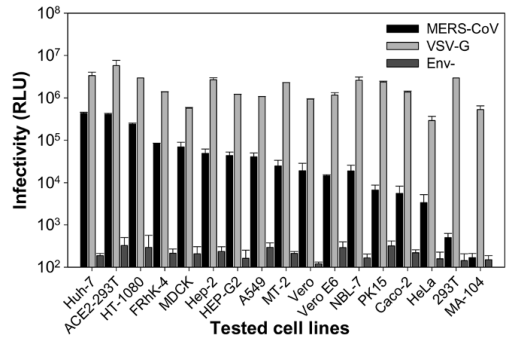
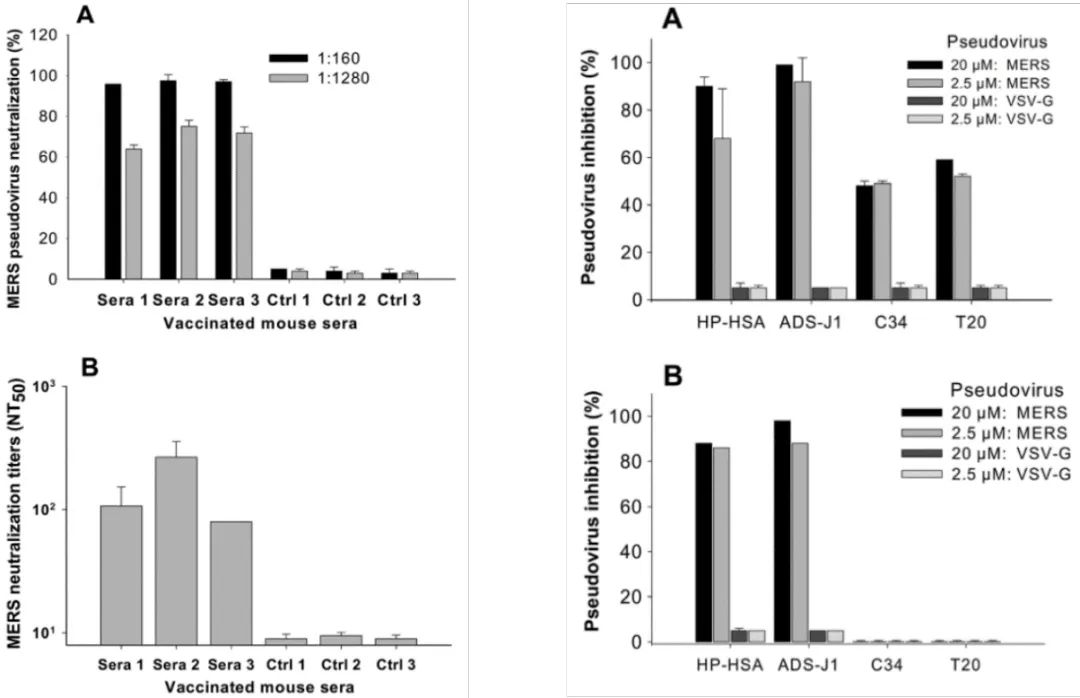 MERS-CoV假病毒对人和非人宿主的多种靶细胞中的细胞嗜性。VSV-G和Env-假病毒分别用作阳性和阴性对照。数据表示为96孔板中4个平行孔的平均相对发光强度(RLU)±SD。 重复三遍,结果相似。通过重要病毒感染力测试,作者指出几乎所有测试的人细胞和动物细胞都能被伪病毒感染,这也指出模型的正确性。结果如下图所示:
MERS-CoV假病毒对人和非人宿主的多种靶细胞中的细胞嗜性。VSV-G和Env-假病毒分别用作阳性和阴性对照。数据表示为96孔板中4个平行孔的平均相对发光强度(RLU)±SD。 重复三遍,结果相似。通过重要病毒感染力测试,作者指出几乎所有测试的人细胞和动物细胞都能被伪病毒感染,这也指出模型的正确性。结果如下图所示:
 左:疫苗血清对病毒抗体中和和抑制检测(A为伪病毒,B为CPE方法)再看细胞水平病毒抑制实验(发光信号已转化为纵轴抑制率,左B为CPE法对比)
左:疫苗血清对病毒抗体中和和抑制检测(A为伪病毒,B为CPE方法)再看细胞水平病毒抑制实验(发光信号已转化为纵轴抑制率,左B为CPE法对比)
右:小分子(HP-HSA和ADS-J1)和肽(C34和T20)对假病毒在NBL-7(A)和Huh-7细胞(B)的抑制作用
结果显示,伪病毒模型不仅可有效用于疫苗,也可用于小分子和多肽的筛选实验。
另外,文中也使用MMR光吸收检测了小分子细胞毒性(亦可荧光或发光),通过分析,作者论述了实验中伪MERS-CoV的感染力降低并非由于小分子的细胞毒性造成的。本实验中,化学发光检测在实验中非常必要,超高灵敏度,背景低,稳定性好,可有效排除False-Hit干扰,这也是大多数基于伪病毒模型的实验均采用发光检测的重要原因。此外,基于孔板的细胞实验模型也为高通量的筛选奠定了基础。
另据文献报道,基于伪病毒的抗体中和实验精验证可有效作为操作繁琐的传统CPE实验(成像检测)替代选择,提升通量,缩短实验周期,大大提升研发效率。
02
针对第二种的靶点的药物,一般都属于酶抑制剂。大多数这类药物在成为候选药物前(Candidate),通常需要用高通量筛选的方式从化合物库(或合成)中筛出苗头小分子(Hit),然后一般再通过细胞学实验筛选出具有初步有活性的先导化合(lead),接着还需要再经过构效、ADME和代谢等优化成为Candidate。

这个过程周期一般10个月-2年,但由于每次冠状病毒疫情爆发的高度暂时性(无积累病例),针对冠状病毒的药物开发大都停留在活性化合物阶段。比如类似的有这篇2019年的文章,主要描述的是对MERS冠状病毒木瓜蛋白酶样蛋白酶(PLpro)抑制剂的高通量检测和筛选[8]。
文中设计用于最终检测的酶荧光底物为Z-Arg-Leu-Arg-Gly-Gly-AMC,初筛中使用了Tecan自动化液体处理工作站完成实验步骤的高通量分液,并使用Tecan MMR高灵敏荧光功能检测化合物对酶活性抑制,初次在30000个化合物中确认48 个 hit,再经过结构和活性基团分析,并用酶标荧光酶促动力学检测活性抑制效果,最后选出23个候选化合物用于进一步研究。
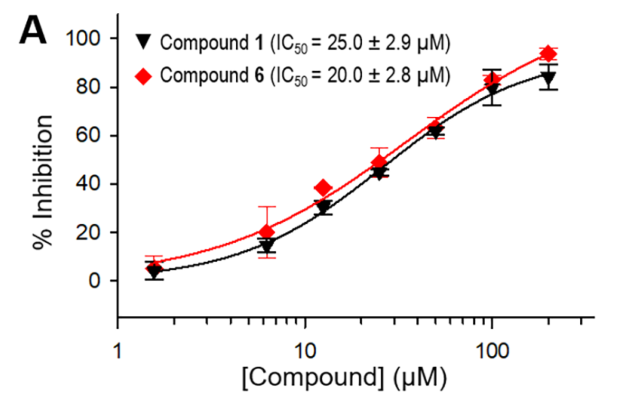
 Hit验证,使用SigmaPlot 中的Hill方程拟合得到化合物1和6的IC 50曲线。1和6的IC 50值分别确定为25.0 μM和20.0μM。(纵轴抑制率是由荧光终点检测信号转换得到)在这23个化合物中,2个抑制活性最好的剂量反应数据如下图:
Hit验证,使用SigmaPlot 中的Hill方程拟合得到化合物1和6的IC 50曲线。1和6的IC 50值分别确定为25.0 μM和20.0μM。(纵轴抑制率是由荧光终点检测信号转换得到)在这23个化合物中,2个抑制活性最好的剂量反应数据如下图:
需要补充的是,在细胞学水平对小分子进行毒性检测是早期研发必要的步骤(文中未体现),一般在MMR上可使用荧光和生物发光手段对此项指标进行高通量高灵敏地筛查。
鉴于这次新冠疫情来的异常凶猛,常规新药开发在时间上根本不允许,因此很多机构使用有类似机理的已批准或待批准的抗病毒药物和化合物用于新冠病毒治疗研究(Drug repurposing)。在这些药物中,有些在通过细胞和动物水平的药效试验后,已直接进入临床三期试验。
在临床毒性已明确的前提下,这样的策略肯定会大大提升药物进程,这里也非常期待尽快听到这些药物临床成功的消息。同时,也期待其中部分药物不久后能进一步被优化,以产生更好治疗效果,因为毕竟它们早期是针对其它病毒开发的。
友情链接:
Copyright © 杭州百赛惟思生物科技有限公司 All rights reserved. 腾云建站仅向商家提供技术服务 网站地图


